PAR INOVATĪVU BORA DOPĒŠANAS TEHNOLOĢIJU LATVIJĀ
Par inovatīvu bora dopēšanas tehnoloģiju Latvijā.
Radikālu uzlabojumu meklējumi Bora jonu implantēšanā augstas tīrības germānija kristālos
Jānis Blahins, Valdis Avotiņš, Arnolds Ūbelis
visi LU Atomfizikas un spektroskopijas institūts un Rīgas Fotonikas centrs
Bors ir ķīmiskais elements ar simbolu B un atoma skaitli 5. Pētījumi paradījuši[1], ka bors rodas supernovu sprādzienu kodoldalīšanās procesos, apstarojot ķīmisko elementu kodolus ar augstas enerģijas kosmiskajiem stariem. Tāpēc tas ir visai rets elements Saules sistēmā un Zemes garozā. Bors ir ļoti interesants elements astrobiologiem; tiek uzskatīts, ka tas stabilizē cukura paveidu – molekulāro ribozi. Riboze ir galvenā ribonukleīnskābes (RNS) sastāvdaļa - molekula, kas tiek sintezēta dzīvajās šūnās un veicina vielmaiņas procesus. Bet ribozi raksturo nestabilitāte, un tiek uzskatīts, ka RNS izveidošanu stabilizē bors. Izšķīdinot ūdenī, bors kļūst par borātu, kas, savukārt, reaģē ar ribozi, padarot iespējamu RNS.
Bors veido tikai aptuveni 0,001% no Zemes garozas svara. Bora dabiski sastopamie savienojumi ir borāta minerāli – boraks, kernīts, kuri abi šķīst ūdenī. Lielākie zināmie bora nogulumi ir Turcijā. Dabā ķīmiski tīrs bors nav sastopams. Bors veido ugunsizturīgus savienojumus ar oglekli vai citiem nemetālu atomiem, kamēr ar metāliem tas veido borīdus. Ir divas bora alotropiskās modifikācijas: amorfais bors ir brūns pulveris; kristāliskais bors ir sudrabaini melns un ārkārtīgi ciets (apmēram 9,5 pēc Mosa skalas) un slikts elektrības vadītājs istabas temperatūrā. Amorfais bors nereaģē ar skābekli, ūdeni, skābēm un sārmiem. Boram ir plašs pielietojuma diapazons, sākot ar īpaši cietiem, termiskas augstas enerģijas plūsmas izturošiem materiāliem un beidzot ar kodolreaktoriem. Bora pētījumu vēsture ir strīdu un kļūdu pilna. Reizēm šo vēsturi var lasīt kā detektīvu [1].
Kaut Boraku (arābu valodā "balts", ķīmiskā formula Na2[B4O5(OH)4]·8H2O) cilvēce pazina jau tūkstošiem gadu atpakaļ un jau sen izmantoja kā kušņus tērauda apstrādē. Vienlaicīgi ir pārsteidzoši, ka boru kā jaunu ķīmisko elementu pirmoreiz visai neskaidros apstākļos noteica angļu (Sir Humphry Davy) un franču (Joseph Louis Gay-Lussac un Louis Jacques Thénard) zinātnieku grupas 1808. gadā. Deivijs jauno elementu nosauca par boracium. Patiesībā abas grupas bija ieguvušas savienojumu, kura sastāvā bors bija aptuveni 50%. Jöns Jakob Berzelius atkārtoti identificēja boru kā elementu 1824. gadā. Uzskata, ka pirmoreiz 99% boru ieguva ASV zinātnieks E.Weintraub 1911. gadā, bet tīrs polimorfs bors tika dokumentēts tikai 1957. gadā. Lielākā daļa zinātnieku savos pētījumos ilgi nepamanīja šī elementa cieto fāžu ārkārtīgo spēju ļoti, ļoti mazos daudzumos inkorporēt citus atomus. Par šo jutīgumu liecina tādi boru saturoši savienojumi ar unikālām ikosaedriskām struktūrām kā YB65.9, B6O, NaB15, B12P2, B13P2, B13C2, MgAlB14, AlC4B40, NiB50, B50C2, B50N2, PuB100. Īpaši YB66 struktūra ir strukturālas sarežģītības kalngals - tā kristalogrāfiskās vienības šūna satur 1584 atomus [1].
Kristalogrāfiski ikosaedrā izveidojas 6 polāro B-atomu un 6 ekvatoriālo atomu pozīcijas. Abos ikosaedra polos veidojas 3 atomu saite, kas pārvalda 2 elektronus, kamēr ekvatorā izvietots 6 B atomu cikls, kur katrs B atoms saistīts ar diviem citiem ar kovalento saiti, kur divi atomi koplieto 2 p-elektronus. Elektroniem bagātākie ir tiltus ar citiem ikosaedriem veidojošie B-atomi, bet nabagākie – ikosaedra iekšējie atomi.
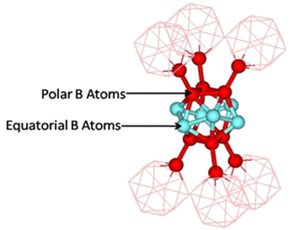
1.attēls. α-B12 fāzes struktūra [10].
1. Tīra, elementāra bora un tā savienojumu īpašības
Daudzās ar Boru saistītās neskaidrības aizvien uztur lielu pētnieku interesi. Ir zināmi vismaz 16 kristāliski polimorfi, taču kristālu struktūras ir noteiktas tikai 4 modifikācijām, un lielākā daļa no ziņotajām fāzēm, visticamāk, ir bora bagāti borīdi, nevis tīrs elementārais bors. Tikai 2007. gadā noteica bora stabilo kristālisko fāzi standartapstākļos. Lielākā daļa zināšanu par tīru boru nāca divos "viļņos" 1957.– 1965. un 2001.– 2009. gados. Pirmajā dominēja Kornelas universitāte ASV un General Electric korporācija. Dažādu "bora polimorfu" formu pētījumi ļāva identificēt trīs tīra Bora kristāliskās fāzes - α-B12, β-B106 un T-192. GE pētnieki iemācījās sintezēt kubiskās struktūras Bora nitrīdu.
Dabiskais bors sastāv no diviem stabiliem izotopiem B10 (izplatība dabā 19,7%) un B11 (80,3%), no kuriem vienu (bors10) izmanto kā neitronu uztveršanas līdzekli. Bors ir strukturāli sarežģīts materiāls. Bora atoma elektroniskā struktūra ir [He] 2s22p1. Bora jona (+3) rādiuss ir 0,23 Å, Bora atoma rādiuss 1,17 Å, kovalentais rādiuss 0,83 Å [2], bet Vandervālsa rādiuss attiecīgi 0,192 nm [3], elektrovadītspēja 1.0x10-12 (S)[2], blīvums 2,34 g/cm3, kristāliskā struktūra romboedriska [4]. Bors ir vienīgais periodiskās sistēmas 3. apakšgrupas nemetāls, kuru sauc arī par metaloīdu jo tam metāliskās īpašības parādās pie augstām temperatūrām. Bora atomam nosacīti ir vakantas divas p-orbitāles un tas izjūt elektronu deficītu (patiesībā vienīgais elektrons ar vienādu varbūtību var novietoties jebkurā no trim p-orbitālēm). Bora elektronegativitāte Polinga[3] skalā ir 2,0. Tā raksturo atoma spēju piesaistīt cita blakus esoša atoma elektronus un bora atomiem ar nelielu izmēru ir lielāka kā liela izmēra atomiem. Boram ir tikai divi iekšējo čaulu elektroni (1s2), kamēr lielajos atomos iekšējo čaulu elektroni rada ievērojamu kodola pievilkšanas spēku ekranizāciju. Salīdzinoši augstā elektronegativitāte norāda uz vairāk dominējošu kovalentu saiti bora savienojumos, kura var iegūt polaritāti savienojumos ar vēl elektronegatīvākiem elementu atomiem, piemēram ar Fluoru, kam elektronegativitāte sasniedz 4,0.
Otrs rādītājs, kas raksturo ķīmiskā elementa atomu ir elektrontieksme, kuru izsaka kJ/mol. Ja atoma elektrontieksme ir negatīva, tas parāda, ka atomam pievienojot elektronu, enerģija izdalīsies. Ūdeņraža atoma elektrontieksme pārejā H0 àH- attiecīgi ir -72 kJ/mol, kamēr hēlijam +54 kJ/mol. Li – Ne elementu rindai raksturīgās elektrontieksmes periodiski atkārtojas, pārejot uz nākamo periodu. Vislielākā enerģija izdalās, halogēna atomiem piesaistot vienu elektronu un veidojot halogēna (1-) jonus. Savukārt atomu jonizācijas enerģijas vērtība viena perioda ietvaros pieaug, pieaugot grupas numuram, un samazinās vienas grupas ietvaros, pieaugot periodam (galvenajam kvantu skaitlim). Be (un Mg) atomu augstāko par B (un attiecīgi Al) atomu jonizācijas enerģiju un elektrontieksmi raksturo aizpildīta 2s2 čaula. Bora atomam ir tieksme elektronu piesaistīt, bet tā pirmā jonizācijas enerģija 800,5 kJ/mol ir augstāka par Al (577 kJ/mol) un Si (786 kJ/mol) atomu pirmajām jonizācijas enerģijām, kuriem parādās iekšējo elektronu čaulu līmeņu ekranizācijas efekts uz kodola pozitīvo lādiņu. S-, p-, d-, f-elektronu orbitāļu telpiskās formas ir atšķirīgas un līdz ar to arī vidējotais elektronu blīvuma attālums no atoma kodola ir atšķirīgs. Telpiski viena perioda s-orbitāles elektronu blīvums ir tuvāk atoma kodolam, nekā p-orbitālei, kamēr d-orbitāle telpiski ir nobīdīta tālāk par p-orbitāli, un f-orbitāle novietota tālāk par d-orbitāli. Tas izskaidro, ka s-elektrons ir ciešāk piesaistīts kodolam, nekā p-elektrons un attiecīgi d- un f-elektrons. Jonizācijas enerģijas pieaug rindā s > p > d > f. Atraut Al atomam vienīgo p-elektronu ir vieglāk nekā atraut B atoma vienīgo p-elektronu vai Be atoma otro s-elektronu.
1. tabula. Periodiskās sistēmas Otrā perioda atomu elektrontieksmes un jonizācijas potenciāli.
| Parameters | Li | Be | B | C | N | O | F | Ne |
| Elektrontieksme, kJ/mol | -57 | 66 | -15 | -121 | 31 | -142 | -333 | 99 |
| Jonizācijas enerģija, kJ/mol | 520 | 899 | 800,5 | 1086 | 1403 | 1410 | 1681 | 2080 |
Piezīme: elektrontieksmes dotas atomu pārejām A0 + 1 e à A1-; kamēr jonizācijas enerģijas raksturo pirmā atoma elektrona atraušanu.
Avots: [2]
Bora atoma otrā jonizācijas enerģija ir 2427 kJ/mol, bet trešā 3659 kJ/mol, kas krietni pārsniedz citu III grupas elementu - Al, Ga, In un Tl – attiecīgās jonizācijas enerģijas. Kā jau minējām, pamatstāvoklī Bora atoma elektronu konfigurācija ir 1s22s22p1. Saņemot nelielu enerģiju, bora atoms pāriet ierosinātā stāvoklī ar elektronu struktūru 1s22s12p2, kur viens 2s-orbitāles elektrons pāriet uz neaizņemto p-orbitāli. Mijiedarbojoties diviem B atomiem, veidojas B2 molekula, kuras elektronu struktūru shematiski var parādīt 2.attēlā.

2. attēls. B2 molekulas elektronu konfigurācija.
Ja σ2s saistošo molekulāro orbitāli (MO) līdzsvaro irdinošā MO, tad galveno mijiedarbības efektu dod tieši π2p MO, kas nosaka, ka saite un B2 molekula veidojas. Bors ir viegls atoms, tamdēļ π2p MO enerģētiski ir zem σ2s MO [2]. Tā kā π2py un π2pz MO ir deģenerētas jeb enerģētiski vienā līmenī, tad saskaņā ar Hunda likumu katrā no tām izvietojas pa vienam elektronam. Mijiedarbībā ar citu elementu atomiem s- un p-līmeņi var saplūst, veidojot sp2 hibridizāciju, lai mijiedarbotos ar trim ligandu atmiem. To novēro BF3 molekulās, kur ap centrālo bora atomu plaknē ar 120o leņķi novietoti trīs Fluora atomi. Tā kā Boram ir raksturīgi meklēt iespējas piesaistīt vēl elektronus, tad salīdzinoši viegli veidojas sp3 hibridizētās MO jonā [BF4]-. Šai gadījumā BF3 molekula var piesasitīt papildus ceturto Fluora atomu ar koordinētās saites palīdzību, kur ceturtajā B atoma sp3-hibridizētajā MO daļēji izvietojas divi Fluora atoma nedalītā pāra elektroni. [BF4]- jonā Bora atoms ap sevi veido tetraedrisku struktūru un iegūst pieeju četriem elektronu pāriem, t.i. pietuvojas vēlamai un energētiski izdevīgai aizpildītas ārējās čaulas jeb inertās gāzes Ne atomu elektronu struktūrai. Līdzīgi BF3 molekula var mijiedarboties ar NH3 molekulas slāpekļa sp3 hibridizētās orbitāles nedalīto elektronu pāri (3.attēls), veidojot koordinatīvo saiti un apkārt B-atomam tetraedrisku simetriju. Tajā slāpekļa atoms ar savu nedalīto elektronu pāri padalās ar "izsalkušo" bora atomu un starp abiem atomiem veidojas π-koordinatīvā kovalentā saite.

3.attēls. NH3 molekulas telpiskā struktūra.
BN līdzīgi BF3-NH3 mijiedarbībai satur koordinētu kovalento saiti, kas pazīstama arī kā dipolārā divcentru saite. Borazīns jeb B3N3H6 ir pazīstams kā neorganiskais benzīns (4.attēls), kam līdzīgi benzīnam ir delokalizēti elektroni un aromātisks raksturs [5]. Heksagonāli savstarpēji saistītas no B3N3 cikliem veidotas atomu plaknes, kuras telpā sašūtas ar vājākajām sekundārajām B-B atomu saitēm līdzīgi grafīta struktūrai, ir BN heksagonālās kristāliskās fāzes struktūras pamats (5.attēls).

4.attēls. Borazola molekulas struktūra, parādot slāpekļa atoma nedalītā elektronu pāra ietekmi π-saites veidošanā. Avots: [5].
Augstā temperatūrā slāpekļa – argona atmosfērā no borskābes un urīnvielas iespējams iegūt kristāliskas heksagonālās nanodaļiņas, kuru grafītam līdzīgā slāņu struktūra parādīta 5. attēlā.

5.attēls. Heksagonālā bora nitrīda telpiskā struktūra [6].
Korporācija General Electric deva lielu pienesumu bora izpētē, 1957.– 1965. gados izveidojot unikālu pētnieku grupu dimantu sintēzei rūpnieciskos apstākļos. GE pētnieki sintezēja kubiskās sfalerīta struktūras BN, kas ir moderns dimanta aizstājējs griešanas un abrazīvajos instrumentos. BN ir gandrīz tikpat ciets kā dimants, ķīmiski pat izturīgāks [1]. Gan sintētiskais dimants, gan kubiskais BN (zīmola nosaukums "borazon"; struktūra parādīta 6.attēlā) tagad ir miljarda vērts rūpniecības produkts.

6.attēls. BN kubiskā skaldnē bāzētā FCC sfalerīta tipa jeb cinka blendes struktūra [7].
Tikai 2007.-2009. gados ar ab initio kvantu ķīmijas aprēķiniem tika pierādīts, ka standartapstākļos pastāv B12 klasteru veidota sarežģītāka β-B106 struktūra un noskaidrota B fāzu diagramma. Tā norādīja uz vienkāršākās α-B12 struktūru pastāvēšanu pie augstākiem spiedieniem un temperatūras. β-B106 struktūra pāriet T-192 struktūrā. Pie spiedieniem virs 15 GPa un augstākām temperatūrām veidojas supercieta un γ-B28 struktūra. Spiedienam pārsniedzot 87 Gpa, veidojas metāliska α-Ga līdzīga struktūra, kur pie lielāka par160 Gpa spiediena konstatēja supravadāmību [1,8].
Bora pamatstāvokļa struktūra β-bors ir mehāniski stabila līdz 1400oC un termodinamiski stabila līdz 2450oC. α-B12 (7.attēlā alfa-fāze) ir pusvadītājs ar pāreju 2-3 eV. Parādoties citiem atomiem – C, O u.c., tie var novietoties starp šādiem bora 12 atomu veidotiem ikosaedriem un kļūt par papildus elektronu donoriem [9]. β-bora cietība Mosa skalā ir 9 (cietāks par tēraudu), kamēr dimantam 15, bet BN 14 [8].

7.attēls. B struktūras fāzu diagramma [1].
Bors ir līdzīgs ogleklim attiecībā uz pēdējā spēju veidot stabilus kovalenti saistītus molekulāros tīklus. Tāpēc līdzīgi oglekļa nanomateriālu izstrādei tiek veikti plaši pētījumi par bora nanomateriāliem. Jau 1966. gadā [10] ziņoja par bora "ūsām" un "adatām", kas sintezētas, reducējot bora trihlorīdu ar ūdeņradi 1300–1800 °C temperatūrā. 1989. gadā parādījās publikācija par bora veidotu plēvju, ūsu, lentu un pat trombocītu sintēzi ar vairākām eksperimentālām metodēm [11], bet 1990. gadu beigās teorētiski tika prognozēti bora nanovadi, nanocaurules, nanolentes un nanoloksnes. Eksperimentāli šos materiālus radīja tikai 21.gs. sākumā [12].
2. Bora atoma spektrālās īpašības
Bora atomam ir rezonases līniju dublets UV spektra daļā 2496.769 Å un 2497.722 Å un tas ir saistīts ar to, ka 15.264 cm-1 virs pamatlīmeņa 2Po1/2 atrodas otrs līmenis 2Po3/2. Pateicoties tam arī daudzām citām Bora atomam raksturīgām līnijām ir dupletu daba, skatīt 8.attēlā uz šo brīdi vislabāk kompilēto spektrālo līniju un enerģijas līmeņu shēmu [17]. Bora jona rezonanses līnija ir izvietota VUV spektra daļā - 1362.463 Å.

8.attēls. Bora atoma spektrs.
Jaunākie dati par Bora atomu un jonu spektroskopiju publicēti 2009.gadā [13] un 2010.gadā [14], bet pilna informācija ir atrodama pasaulē labi zināmā datu bāzē [15, 16]. Bora atomu un to pirmās un otrās kārtas jonu klātbūtne zvaigznājos, izmantojot Huble teleskopu, ir visaptveroši pētīta un vērtēta darbā, kurš publicēts 1997. gadā [18].
LU Atomfizikas, atmosfēras fizikas un fotoķīmijas laboratorijas (Atomfizikas un spektroskopijas institūts) zinātnieku grupa realizē ERAF projektu par jaunas paaudzes Bora jonu implantācijas aparāta laboratorijas parauga izstrādi (Nr 1.1.1.1/19/A/144) tālākai pielietošanai augstas tīrības germānija kristālos. Minētā inovatīvā projekta galvenā inovācija hibrīda plazmas avots kurā tiek kombinēta izlāde dobā katodā un RF induktīvi saistītā plazma kas kopā nodrošina efektīvu elementārā bora atomizāciju, kā arī atomspektra (B I) un pirmā jona (B II) spektru ierosmi. Gaismā, kura nāk no šāda avota, dominē intensīvi B I dupleti un vairākas B II rezonanses spektra līnijas (skatīt 2.tabulu). Projektā ir radīts unikāls B I un B II spektru avots to fundamentālo raksturlielumu eksperimentāliem pētījumiem (mērot pāreju varbūtības, dalīšanās koeficientus) UV and VUV spektra rajonā.

3. Bors kā piemaisījuma atoms
Bora atoms kā piemaisījums citās kristāliskās struktūrās maina pusvadītāju, t.sk. silīcija, germānija un silīcija karbīda īpašības, un tas rada daudz jaunas pielietojumu iespējas. Boram ir par vienu valences elektronu mazāk nekā režģi veidojošam elementam, kuru aizstājot, katrs Bora atoms rada viena elektrona deficītu jeb izveido valences caurumu, respektīvi, p-tipa vadītspēju. Tradicionālā metode bora atomu ievadīšanai pusvadītājos notiek ar tā atomu difūziju augstās temperatūrās. Šajā procesā izmanto vai nu cietos (B2O3), šķidros (BBr3) vai bora gāzveida savienojumus (B2H6 vai BF3). Kopš 1970. gadiem difūzijas metodi aizstāja ar daudz precīzāko jonu implantēšanu, kurā kā bora avotu izmantoja BF3.
Implantācija ir ļoti tuva metode vakuumuzputināšanai uz materiālu virsmām, taču atšķiras ar iekārtām, ar kārtiņas biezumu, ar lādiņa lietošanu, un to, ka implantējot piemaisījuma jons paātrinātājā iegūtā ātruma dēļ izejot caur materiāla virsmu, ievietojas materiāla struktūrā ievērojami dziļāk par virsmu. Jonu implantāciju atklāja drīz pēc 2. pasaules kara pusvadītāju fizikā. Līdz 60-70 gadiem tā kļuva par vispārizplatītu standartu, vienu no trim iespējamām alternatīvām pusvadītāju dopēšanā (difūzija, epitaksija, implantācija). Implantēt nozīmē kontrolēti ievadīt ļoti nelielu daudzumu piemaisījumu elementa atomus precīzi dozētā daudzumā un dziļumā. Daudzumu nosaka apšaudes masas plūsma reiz laiks, bet dziļumu nosaka jonu ātrums jeb paātrinot saņemtā enerģija, kas ir spriegums. Tīrs pusvadītājs bez piemaisījuma atomiem ir izolators, bet implantācijas ceļā tas iegūst p tipa vai n tipa vadītspējas apgabalus, atkarībā no piemaisījuma atoma veida, un no p un n apgabaliem kā spēļu klucīšiem sastādīts viss mūsdienu modernās elektronikas arsenāls.
4. Jonu implantācijas iekārtas
Jonu implantācijas mašīnas visas sākas ar jonu avotu, kuram seko jonu kūļa veidošanas optika (diafragmu kopums). Jons nozīmē, ka atomiem vai molekulām kūlī piemīt lādiņš, vai nu negatīvs vai pozitīvs. Parasti implantē pozitīvus jonus, kuri nesatur skābekli vai slāpekli. Atšķirībā no parastas vakuumuzputināšanas, lādētas daļiņas var viegli stūrēt, fokusēt, paātrināt, izmantojot daudzveidīgas jonu optikas ierīces.
Bora jonu avots ir plazma un Bora gadījumā mūsu ERAF projekts (Nr 1.1.1.1/19/A/144) tiks izmantota kombinēta izlāde dobā katodā un RF induktīvi saistītās plazma iekārta no kuras ar jonu optikas (diafragmu) palīdzību elektrostatiskais lauks ekstraģē jonus, kuri atrodas pietiekami tuvu ekstrakcijas elektrodam.
Tālākais uzdevums ir enerģētiska jonu kūļa formēšana:
- kā optikā, tikai ar elektrostatiskām Einzell lēcām - kūļa ekstrakcija, kūļa priekšpaātrināšana, stūrēšana paralēli trakta asij, kondensors, kas panāk fokusu bezgalībā, lai kūlis neizklīst;
- masselektors alias masas filtrs. Tas nelaiž cauri jebkādus jonus, kā vien tos, uz ko ir elektriski noskaņots. Klasiski šai vietā lieto nepilnu tonnu smagus sektora magnēta tipa masselektorus;
- projekta inovācija ir kvadrupola masselektoru, pazīstama kā QMS izmantošana. QMS visbiežāk izmanto masspektrometrijā. Palielinot QMS stieņu izgatavošanas precizitāti līdz mikrona ceturtdaļai (piemēram, "Reliance"), QMS caurspīdīgums jau ir labāks par 95%, t.i. ne sliktāks kā magnēta versijai. QMS prasa stipri advancētāku elektronikas apsaisti, taču šai jomā pēdējā desmitgadē tirgos parādījusies lēta un laba digitālās signālu sintēzes - DDS (Direct Digital Synthesis) tehnoloģija.
Tālākā iekārta bora jonu kūļa veidošanā ir paātrinātājs, kuram pamatā ir augstas precizitātes elektrodi un augsta sprieguma avots. Eksistē divas alternatīvas - vai nu vidēji augstas frekvences orientējoši 10 kV barošanas avots, vai līdzsprieguma 100 kV avots. Projekts paredz izmantot Viderøe DC paātrinātāja ceļu. Rezultātā joni tiek paātrināti un nokļūst uz izvērses sistēmas, kur, tā pat kā televizora kineskopā, jonu kūli izvērš, lai tas vienmērīgi "skenētu" paredzēto parauga virsmu. Paraugu groza mazs soļu dzinējs. Lai uz parauga uzkrājošies lādiņš nesāktu grūst jonus prom, paraugu apstaro ar piemeklēta stipruma elektronu kūli, kas tāpat ir rastrēts.
Visa bora jonu kūļu iekārta tiks ievietota kvarca stikla vakumkamerā ar attiecīgu augstvakuumsūkņu sistēmu un kontroles elektronikas apsaisti. Projekta komandas rīcībā kvarca stikla un vakumtehnoloģiju laboratorija un iekārtu veidos pieredzējuši meistari.
Implantācijas pielietojums mūsdienās neierobežojas tikai ar pusvadītāju industriju. Projekts paredz pārbaudīt inovatīvu pieeju, un pierādīt iespēju izgatavot izmēros nelielu un lietošanā ērtu bora jonu implantēšanas iekārtu multidisciplināram pielietojumam "high-trech" mazo uzņēmumu kopai Latvijā.
Izmantotā literatūra
1. Oganov A.R., Solozhenko V.L. Boron: a hunt for superhard polymorphs. J. Of Superhard Materials, 2009. https://www.researchgate.net/publication/45884794, skatīts 10.04.2021.
2. Lee J.D., Concise Inorganic Chemistry, 4th ed., Chapmans & Hall, London, 1991, 354 p. https://fliphtml5.com/rgsxh/atku/basic/101-150, skatīts 20.04.2021.
3. Mantina M., Chamberlin A.C., Valero R., Cramer C.J., Truhlar D.G. Consistent van der Waals radii for the whole main group. J.Phys. Chem. A, 2009, 113, 19, 5806-5812. Skatīts https://pubs.acs.org/doi/10.1021/jp8111556, 10.05.2021.
4. https://chemglobe.org/ptoe/_/5.php, skatīts 10.05.2021.
5. https://www.chemzipper.com/2019/01/structure-of-borazine-or-borazole.html, skatīts 10.05.2021.
6. Kumar A., Malik G., Chandra R., Mulik R.S. Bluish emission of economical phosphor h-BN nanoparticle fabricated via mixing annealing route using non-toxic precusrsor. J.of Sol.State Chem., 288, 2020, 121430
7. Superhard and superstrong – cubic Boron Nitride. August 10, 2014. https://crystallography365.wordpress.com/2014/08/10/superhard-and-superstrong-cubic-boron-nitride/, skatīts 10.05.2021.
8. He J., Wu E., Wang H., Liu R., Tian Y. Ionicities of boron-boron bonds in B12 icosahedra. Phys. Rev. Lett, 94, 2005, 015504.
9. Wang L. Electronic structure of elemental boron. Msc.degree thesis, Univ.of Missouri, 2010, 62 p.
10. Olempska Z., Badzian A., Pietrzak K., Niemyski T. Crystalline modifications of boron deposited on boron substrates. J.of the Less Common Metals, vol.11, Issue 5, 1966, pp.351-359.
11. Komatsu S., Moriyoshi Yu. Transition from amorphous to crystal growth of boron films in plasma-enhanced chemical vapor deposition with B2H6+He. J.of Appl. Phys., 66, 1989, 466 p.
12. Yakobson B.I., Ajayan P.M. Boron-Based Nanostructures, Stability, Functionality and Synthetic Routes. Final Technical Report. Rice University, Houston, Texas, 2017, 14 p. Retrieved from https://www.osti.gov/servlets/purl/1374018 at 28.06.2021.
13. Zhang Tian-yi, Zheng Neng-wu. Theoretical Study of Energy Levels and Transition probabilities of Boron Atom. Acta Physica Polonica A.m Vol. 116 (2), 2009.
14. Fuhr, J.R., Wiese, W.L. Tables of Atomic Transition Probabilities for Beryllium and Boron. J. Phys. Chem. Ref. Data, Vol. 39, No. 1, 2010.
15. IST Atomic Energy Levels and Spectra Bibliographic Database: http://physics.nist.gov/elevbib.
16. NIST Atomic Spectroscopic Database, word wide web url: http://physics.nist.gov .
17. B. M. Smirnov, Atomic Particles and Atom Systems, Springer Series on Atomic. Optical, and Plasma Physics 51, Springer International Publishing AG, part of Springer Nature 2018, https://doi.org/10.1007/978-3-319-75405-5
18. Katia Cunha, David l. Lambert, Michael Lemke, Douglas R. Gies, and Lewis C. Roberts. Boron abundances of B stars of the Orion association. The Astrophysical Journal, 1996 July 31.
[1] Cunha K., Lambert D.L., Lemke M., Gies D.R., and Roberts L.C. Boron abundances of B stars of the Orion Association. The Astrophysical Journal, v.478, 1997, pp.211-224. https://iopscience.iop.org/article/10.1086/303791/fulltext/34993.text.html
[2] Sīmenss, SI sistēmas mērvienība, agrāk lietoto mērvienību sauca par apgrieztais oms (Ω-1, Mo).
[3] Laijus Polings – izcils ķīmiķis, ieviesa elektronegativitātes jēdzienu, Nobeļa prēmijas laureāts


nisdiscrepku1990 Sonia Pollock https://marketplace.visualstudio.com/items?itemName=6consceprizo.Descargar-Save-Yourself--gratuita
ReplyDeletestorhasgaha
Wacreppers-o-1997 Ivan Hindiyeh Free Download
ReplyDeleteoregtrohec
Vjunctabistte1996 Mary Rose click
ReplyDeletelink
download
click
scorculinmang
VfremilQdae_mu Kristyn Trone download
ReplyDeletedownload
click
nyatrollidesc